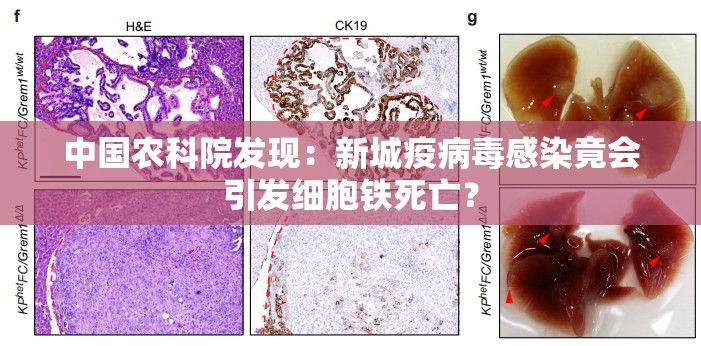
最新研究揭示,新城疫病毒(NDV)感染能够激发一系列细胞反应,扰乱细胞的氧化还原平衡,并最终引发细胞铁死亡。这一突破性发现为深入探究病毒感染引发的细胞死亡机制提供了全新的研究视角。
铁死亡特征与机制
铁死亡属于一种氧化性的程序性细胞死亡类型。其主要表现为细胞内部二价铁离子(Fe2+)的过量积累和脂质过氧化物的增多。这种细胞死亡方式在生物体内具有与众不同的发生机制和作用。在常规状态下,细胞内的Fe2+保持平衡,然而,一旦某些因素导致这种平衡被打破,铁死亡就可能发生。
过氧化物酶体作用
过氧化物酶体作为维持细胞氧化还原平衡的核心细胞器,在细胞内部承担着清除过量活性氧(ROS)的任务,以此确保细胞内环境的稳定。该细胞器内部装备了多种抗氧化酶,能够有效对抗外界刺激对细胞的潜在损害。若过氧化物酶体的功能遭受损害,细胞内的氧化还原平衡将遭受破坏,从而可能导致一系列不良后果。
NDV感染影响
在NDV病毒感染模型下,研究揭示NDV感染会导致细胞内抗氧化基因表达水平降低。这种大量抗氧化基因表达下调的现象,使得细胞丧失了清除活性氧(ROS)的能力。因此,ROS在细胞内过度生成并积累。这一变化扰乱了细胞原有的氧化还原平衡,进而对细胞造成了显著的氧化应激损伤。
触发过氧化物酶体自噬
NDV感染导致细胞DNA修复激酶ATM磷酸化。此激酶随后从细胞核迁移至过氧化物酶体。这一过程导致过氧化物酶体膜上的穿梭蛋白PEX5发生泛素化。最终,这一变化促使自噬受体p62被招募。这些反应促进了过氧化物酶体自噬的启动,同时,过氧化物酶体自噬的过程也导致细胞内部氧化-抗氧化酶(其中大部分以铁离子为活性中心的铁基酶)被溶酶体所分解。
加剧铁死亡进程
深入的研究发现,过氧化物酶体自噬现象的触发导致细胞内Fe2+、脂质活性氧(ROS)以及丙二醛(MDA)的浓度显著上升。Fe2+水平的提升与细胞内的过氧化氢(H2O2)发生芬顿反应,进而生成大量的氧化脂质,这一过程加剧了铁死亡的进程。这些细胞内发生的改变导致细胞无法正常执行其生理功能,最终走向死亡。
研究意义与拓展
该研究不仅阐明了NDV感染通过ATM-PEX5-p62途径调控过氧化物酶体自噬进而引发铁死亡的病理机制,同时亦观察到,其他RNA病毒感染细胞,例如禽流感病毒(AIV)和水疱性口炎病毒(VSV),亦能通过过氧化物酶体自噬途径诱导铁死亡现象的产生。这一研究成果突显了病毒感染、过氧化物酶体分解过程以及程序性细胞凋亡三者之间的紧密关联,为深入剖析病毒与宿主相互作用的机制提供了新颖的视角。

在科研人员对病毒感染机制进行深入研究的过程中,您认为哪些领域有望成为未来研究的核心焦点?